ANVISA – Alteração dos códigos de assunto para petições de medicamentos sintéticos (atualizado em 13/07/2021)
No dia 12 de julho, a ANVISA publicou, em sua página na internet, os novos códigos de assuntos para petição secundária de registro e pós-registro de medicamentos sintéticos. Portanto, os códigos antigos serão excluídos do sistema de peticionamento eletrônico.
Essa alteração visa corrigir inconsistências observadas na fila de análise, além de agilizar e dar maior transparência sobre o andamento das análises das petições de medicamentos. A medida será direcionada primeiramente à medicamentos sintéticos, uma vez que estes passam por análises por unidades distintas dentro da Gerência Geral de Medicamentos (GGMED).
Com esses ajustes, o status da petição primária do medicamento (processo mãe) será atualizado no momento em que for iniciada a análise por qualquer área técnica ligada à GGMED.
Vale ressaltar que, para os medicamentos que já se encontram na fila, serão feitos ajustes no banco de dados da Agência, para incluir os novos códigos de assunto. Portanto, não será necessário que as empresas adotem qualquer ação em relação a esses processos, seja em relação ao Formulário de Informações Relativas à Documentação de Registro (FIDR) ou Parecer de Análise Técnica da Empresa (Pate).
A ANVISA informa ainda que, o prazo de análise das petições permanecerá seguindo o disposto na Lei 13.411/2016. A expectativa é que essas mudanças tragam maior previsibilidade regulatória quanto à publicação de registro de medicamentos, além de maior coerência quanto aos prazos de análise da Agência.
Vale ressaltar que o crescente número de pedidos relacionados à emergência em saúde pública causada pelo novo Coronavírus teve impacto direto no passivo de petições de registro de medicamentos sintéticos, especialmente nas filas de registro de genéricos, similares e inovadores. A expectativa é que a Agência consiga retomar ao prazo de dez meses para primeira manifestação até o final de 2021, e de 60 dias para avaliação de cumprimentos de exigência, se necessário.
Veja abaixo um pequeno resumo com as principais diferenças que podem trazer impacto no momento do protocolo da petição primária e seus aditamentos:
Protocolo da petição primária: não há mudança.
Protocolo das petições secundárias relacionadas a documentação para avaliação de segurança e eficácia, estudo de qualificação de impurezas e produtos de degradação, estudo de biodisponibilidade relativa, estudo de bioisenção, documentação para análise de bula, dizeres de rotulagem e nome comercial, Notificação do Processo da Cadifa (Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo): não há mudança, devendo continuar sendo protocoladas normalmente.
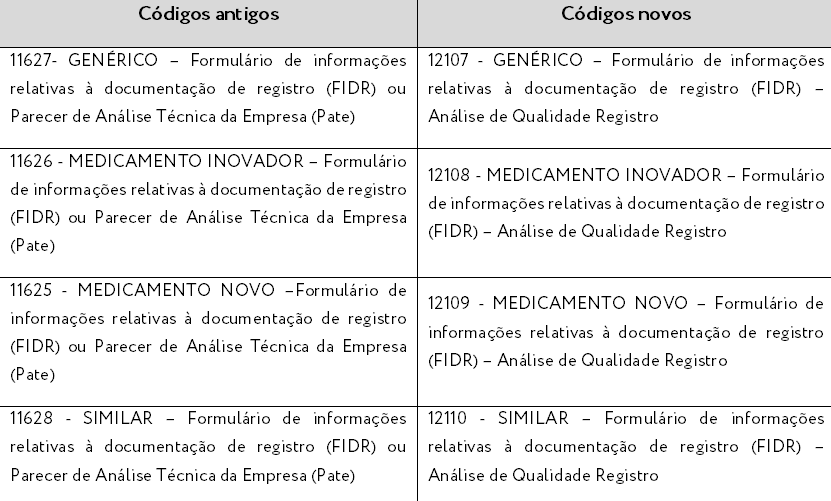
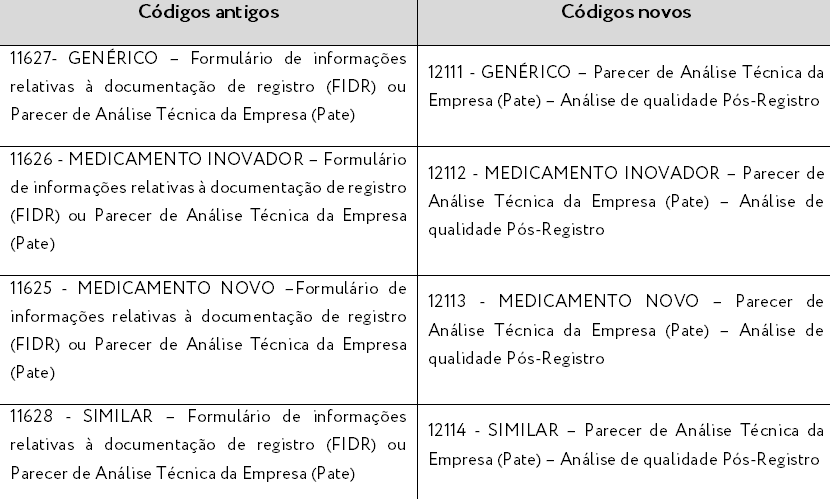
Protocolo de petições relacionadas ao FIDR e ao Pate: haverá mudança do código de assunto a ser protocolado e o expediente dessas petições também servirá para acompanhamento da análise de qualidade (a princípio, somente para petições de registro). Os assuntos antigos e novos estão descritos abaixo.
Confira abaixo os novos códigos de assuntos disponibilizados pela Anvisa.
Registro de Medicamentos:
Pós-Registro de Medicamentos:
A ANVISA disponibilizou todo o material referente ao assunto em seu site, como perguntas e respostas, gravação do webinar e apresentação. Acesse pelo link: https://bit.ly/3xEUCXR.
Acesse as notícias no site da ANVISA por meio dos links: https://bit.ly/3h9cwMA, https://bit.ly/3ysZWNX e https://bit.ly/3r4Ym2m
Acompanhe com a Vita as novidades das Autoridades Sanitárias na América Latina e Europa.

