ANVISA – Atualização do Manual CADIFA de Procedimentos Administrativos (atualizado em 12/01/2023)
No dia 10 de Junho de 2021, a ANVISA disponibilizou, em sua página na internet, uma atualização do Manual CADIFA de Procedimentos Administrativos.
O documento encontra-se na 2ª versão e tem como objetivo trazer alguns esclarecimentos quanto à submissão dos peticionamentos relacionados à CADIFA (carta de adequação do dossiê de insumo farmacêutico ativo), bem como com relação às comunicações entre o detentor do DIFA (dossiê de insumo farmacêutico ativo) e a agência.
Dentre as principais alterações no documento, podemos destacar:
DISPOSIÇÕES INICIAIS:
Inclusão do item “Lista de Abreviações” na parte inicial do documento, com o objetivo de facilitar o entendimento de algumas siglas descritas no texto e utilizadas pela agência.
I. INTRODUÇÃO:
Inclusão das atribuições de cada um dos envolvidos no processo de solicitação da CADIFA associada. Com isso, é de responsabilidade do detentor do DIFA:
- Fornecer carta ao solicitante/detentor do registro de medicamento, com o número de referência do DIFA, autorizando o uso do seu DIFA como parte da análise da petição de registro ou pós-registro do medicamento; ou
- Fornecer a cópia da CADIFA com a declaração de acesso preenchida, pelo detentor do DIFA, em nome do solicitante/detentor de registro do medicamento, quando o IFA já tem CADIFA.
O solicitante/detentor de registro de medicamento, por sua vez, deverá informar a ANVISA o número de referência do DIFA utilizado em sua solicitação de registro ou pós-registro de medicamento por meio de Notificação utilizando um dos seguintes códigos de assunto:
- 11721 – Registro – Notificação do Processo da CADIFA (nos casos em que a petição associada se tratar de registro de medicamento); ou
- 11722 – Pós-Registro – Notificação do Processo da CADIFA (nos casos em que a petição associada se tratar de modificação pós-registro de medicamento).
Foi incluído também um esquema contendo uma breve explicação sobre a ordem dos peticionamentos de CADIFA associada, CBPF de IFA e a petição de registro/pós-registro que estará vinculada a esta CADIFA, facilitando assim a compreensão dos requisitos necessários para cada uma das petições. Ainda, foram incluídos os prazos de análise que serão seguidos pela COIFA para a avaliação dos DIFAs nas categorias ordinária, prioritária ou doenças raras.
Por fim, foi incluído um parágrafo contendo esclarecimentos quanto ao formato da documentação que será apresentada à ANVISA tanto para os protocolos manuais, quanto eletrônicos. Vale ressaltar que o eCTD (eletronic common technical document) ainda não fora implementado no Brasil.
III. ANTES DA SUBMISSÃO:
Atualização da Figura 3 – Atividades prévias ao peticionamento da CADIFA, para inclusão do quadro intitulado como “Organizar DIFA”. Esse quadro se faz necessário, pois, dependendo do tipo de protocolo (manual ou eletrônico), os documentos apresentados no DIFA devem ser organizados de maneira diferente e conforme referenciado no próprio manual e no Guia 24/2019.
1. CADASTRO:
Inclusão de detalhamento quanto aos requisitos aplicáveis ao detentor do DIFA, bem como um breve esclarecimento sobre o cadastro de empresas que pertencem ao mesmo grupo empresarial. Desta forma, a ANVISA sugere a definição de um detentor do DIFA por empresa ou grupo, e este será responsável por representar todos os locais de fabricação. A ANVISA esclarece ainda que a comunicação será feita exclusivamente com o detentor do DIFA, e não será aceita a submissão de documentos por terceiros (ex.: documentos do fabricante do material de partida ou intermediários).
Adicionalmente, o documento “Formulário de Cadastro” também passou por uma atualização quanto ao seu formato e conteúdo. A agência esclarece que o procedimento de cadastro deve ser realizado apenas uma vez para cada detentor do DIFA e gestor de segurança. Nas próximas submissões, a Carta de Autorização, se necessária, deve ser enviada como Anexo 1 ao Formulário de Petição.
2. TIPO DE PETIÇÃO:
Houve a revisão do documento “Lista de Petições relacionadas a CADIFA”, bem como a inclusão de um maior detalhamento sobre os documentos que devem compor cada uma das petições (módulos 1, 2 e 3 do CTD) do protocolo manual ou eletrônico. Com relação à CADIFA associada, foi informado ainda que, caso o número de referência do DIFA não seja informado pelo detentor/solicitante de registro do medicamento por meio de código assunto específico (11721 ou 11722), a solicitação de CADIFA Associada não será analisada e será encerrada.
Para as solicitações de CADIFA Não Associada, a agência esclarece que, caso a submissão não tenha sido demanda pela ANVISA, esta não será analisada e será encerrada. Caso seja deferida, ela poderá ser utilizada em uma solicitação de registro/pós-registro de medicamento, basta que o detentor do DIFA informe o número de referência e envie a carta de autorização para utilização do DIFA como parte da análise da petição do medicamento.
Adicionalmente, a Tabela 1: Quando solicitar uma petição primária e qual documentação apresentar foi atualizada, e foi incluída uma nova coluna com desenhos esquemáticos sobre quais documentos devem ser apresentados em cada um dos assuntos relacionados à CADIFA. Foi incluído também esclarecimentos quanto ao protocolo de DIFA semelhante, o qual deve ser submetido por completo para avaliação pela ANVISA, independentemente das informações que foram submetidas no DIFA original.
Para as petições de mudança pós-registro, a agência esclarece que a documentação comprobatória requerida pela mudança, conforme Anexo II da RDC 359/2020, deve ser enviada na seção 1.7.4 do Módulo 1. Além disso, quando esta alteração atualizar alguma seção do Módulo 3, esta também deverá ser enviado para avaliação.
3. TIPO DE PROTOCOLO:
Inclusão de esclarecimentos quanto ao formato da documentação que será protocolada manualmente, ou seja, esta deverá ser no formato CTD, em suporte eletrônico e atender aos requisitos do Guia 24/2019. Adicionalmente, para esse tipo de protocolo é necessária a realização da transação no sistema de peticionamento eletrônico, a qual será concluída com a entrega da documentação em mídia eletrônica na ANVISA.
4. ORGANIZAÇÃO DO DIFA:
Inclusão dos documentos “Representação esquemática da organização do DIFA” e “DIFA modelo”, os quais trazem exemplos com relação ao formato e a nomenclatura dos documentos que serão apresentados no DIFA, como pode ser visto nos prints de tela abaixo:
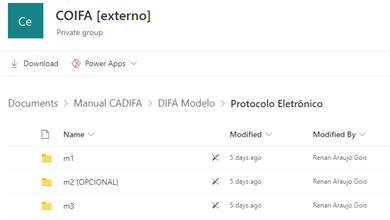
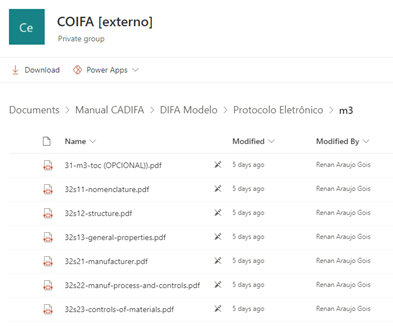
Logo após a escolha do Módulo, é possível ver a disposição e organização dos documentos, bem como a sugestão de nomenclatura para cada um deles
Revisão do documento “Sugestão de Nomes” e maior detalhamento das informações que devem ser apresentadas nas seções 1.2.2 – Justificativa, 1.2.4 – Cópia de Exigência Técnica, 1.2.5 – Comprovante de quitação da TFVS, 1.3.2 – Respostas recebidas via Central de Atendimento e 1.3.3 – Ofícios em resposta à questionamentos enviados à Agência, do Módulo 1.
Com relação aos dados de qualificação de impurezas e produtos de degradação, o manual menciona que essa discussão poderá referenciar estudos não-clínicos e clínicos apresentados na solicitação de registro de medicamento. De forma alternativa, esses estudos poderão ser apresentados também na seção “3.2.S.3.2 Impurezas”, do Módulo 3, uma vez que o DIFA não possui os Módulos 4 e 5.
IV. SISTEMAS DE PETICIONAMENTO
Inclusão de informações relacionadas ao processo de atualização e migração dos sistemas eletrônicos da ANVISA, além do esclarecimento de que os peticionamentos relacionados à CADIFA deverão utilizar o sistema antigo (Peticionamento Eletrônico) e o cumprimento de exigência deverá utilizar o sistema novo (Solicita).
Em 31 de agosto de 2022, a ANVISA publicou uma atualização do Manual CADIFA de Procedimentos Administrativos. A 3ª versão (agosto, 2022) do documento conta com as seguintes alterações:
- Migração das petições relacionadas à CADIFA para o Sistema Solicita, impossibilitando o protocolo manual ou por meio do Peticionamento Eletrônico;
- Inclusão de informações sobre usuário regulatório, que se difere do gestor de segurança, pois, este terá acesso a informações peticionadas por todos os outros gestores de segurança vinculados a mesma empresa;
- Inclusão de esclarecimentos com relação ao preenchimento do Quadro Comparativo (Anexo 8 do Formulário de Petição);
- Instruções sobre como visualizar arquivos submetidos e como salvar uma submissão não concluída no sistema Solicita. (atualizado em 09/09/2022)
No mês de janeiro de 2023 foi publicada uma nova revisão do documento no site da ANVISA. O Manual CADIFA de Procedimentos Administrativos nº 01, 3ª versão, agora encontra-se na Revisão 3.1 e foi publicado apenas para ajustes de formatação, sem que houvesse alterações significativas no conteúdo do texto.
Acesse o documento na íntegra pelo link: https://bit.ly/3k5ulQy.(atualizado em 12/01/2023)
Adicionalmente, seguem abaixo alguns links relacionados à CADIFA:
- Lista de Petições Relacionadas a CADIFA: https://bit.ly/3BtH4CH.
- Representação Esquemática de Submissão do DIFA: https://bit.ly/3B7Dlt0.
- Sugestão de nome para os arquivos dos peticionamentos relacionados à CADIFA: https://bit.ly/3eApwvK.
- Formulário de Cadastro – DHN: https://bit.ly/3L3ElmL.
- Formulário de Petição – CADIFA: https://bit.ly/3DiJxkZ.
Acompanhe com a Vita as novidades das Autoridades Sanitárias na América Latina e Europa.
Entre em contato: info@vitapharmaconsulting.com

